0 : Odsłon:
Ważniejsze metody otrzymywania soli
1. Reakcja kwasu z zasadą - reakcja zobojętniania, np. Ca(OH)2 + 2 HCl = CaCl2 + 2 H2O
Jest to najbardziej uniwersalna metoda otrzymywania soli.
Istota reakcji zobojętniania polega na łączeniu się jonów H+ i OH z utworzeniem bardzo słabo zdysocjowanych cząsteczek wody.
2. Reakcja tlenku kwasowego z zasadą, np. SO2 + Mg(OH)2 = MgSO3 + H2O
3. Reakcja tlenku zasadowego z kwasem, np. K2O + 2 HCl = 2 KCl + H2O
4. Reakcja tlenku zasadowego z tlenkiem kwasowym, np. CaO + CO2 = CaCO3
5. Reakcja metalu z kwasem, np. Zn + H2SO4(rozc.) = ZnSO4 + H2 3Cu + 8HNO3(rozc.) = 3Cu(NO3)2 + 2 NO + 4H2O
Możliwość zachodzenia tych reakcji oraz rodzaj powstających produktów zależą od położenia metalu w szeregu elektrochemicznym oraz od właściwości kwasu użytego do reakcji.
6. Reakcja metalu z niemetalem, np. Fe + S = FeS
7. Reakcja metalu z rozpuszczalną solą mniej aktywnego metalu, np. Mg + 2 AgNO3 = Mg(NO3)2 + 2 Ag
8. Reakcja niemetalu z zasadą, np. Cl2 + 6 NaOH = 5 NaCl + NaClO3 + 3 H2O
9 i 10. Reakcje soli z kwasami i zasadami, podczas których powstają nowe sole.
11. Reakcje między dwiema solami - zachodzą one wówczas, gdy powstają sole trudniej rozpuszczalne od soli stanowiących substraty tych reakcji, np. AgNO3 + NaCl = AgCl(s) + NaNO3
Rozpuszczalność popularnych soli w wodzie :
dobrze rozpuszczalne są sole litowców i amonu;
dobrze rozpuszczalne są azotany, octany i chlorany większość siarczanów należy do dobrze rozpuszczalnych, wyjątkami są: PbSO4, SrSO4, BaSO4, do średnio trudno rozpuszczalnych należą CaSO4 i Ag2SO4;
większość chlorków, bromków i jodków jest dobrze rozpuszczalna z wyjątkiem soli Ag(I), Pb(II) i Hg(I) większość siarczków metali jest trudno rozpuszczalna, dobrze rozpuszczalne są siarczki litowców, berylowców i amonu większość węglanów i ortofosforanów jest trudno rozpuszczalna, dobrze rozpuszczalne są węglany i ortofosforany litowców i amonu.
Wodorosole i hydroksosole W reakcjach kwasów wieloprotonowych z zasadami, tlenkami zasadowymi lub metalami można otrzymać wodorosole, jeśli ilości użytych substratów nie odpowiadają stosunkom stechiometrycznym, wynikającym z reakcji całkowitego zobojętnienia, np.
NaOH + H3PO4 = NaH2PO4 + H2O
diwodoroortofosforan(V) sodu 2 NaOH + H3PO4 = Na2HPO4 + 2 H2O wodoroortofosforan(V) sodu
Wodorosole są z reguły lepiej rozpuszczalne w wodzie od soli obojętnych.
Przykładowo, CaCO3 jest trudno rozpuszczalny w wodzie, natomiast Ca(HCO3)2 - dobrze.
Wodorowę- glany wapnia i magnezu powstają podczas wietrzenia skał wapiennych i występują w wodzie wodociągowej nadając jej tzw. twardość przemijającą, którą usuwamy podczas gotowania wody.
Znany nawóz sztuczny, superfosfat, to diwodoroortofosforan(V) wapnia, który dzięki dobrej rozpuszczalności w wodzie jest dla roślin źródłem łatwo przyswajalnego fosforu i wapnia.
Analogicznie, niecałkowite zobojętnienie zasad wielowodorotlenowych prowadzi do otrzymania hydroksosoli, np. Zn(OH)2 + HCl = Zn(OH)Cl + H2O chlorek hydroksocynku Hydroksosole są gorzej rozpuszczalne w wodzie od soli obojętnych.
Zarówno wodoro- jak i hydroksosole można przeprowadzić w sole obojętne wiążąc występujące w nich jony wodorowe lub wodorotlenowe przez dodanie zasady lub kwasu, np. Ca(HCO3)2 + Ca(OH)2 = 2 CaCO3 + 2 H2O Zn(OH)Cl + HCl = ZnCl2 + H2O
Kwasy tlenowe
Kwas siarkowy (VI)
Siarczan (VI)
Kwas siarkowy (IV)
Siarczan (IV)
Kwas azotowy (V)
Azotan (V)
Kwas azotowy (III)
Azotan (III)
Kwas fosforowy (V)
Fosforan (V)
Kwas węglowy węglan
Kwasy beztlenowe
Kwas chlorowodorowy chlorek
Kwas bromowodorowy bromek
Kwas jodowodorowy jodek
Kwas fluorowodorowy fluorek
Nazwy soli.
Własności fizyczne soli
postać ciała stałe, krystaliczne barwa zazwyczaj biała
rozpuszczalność zależna od rodzaju soli
przewodnictwo
roztwory wodne soli oraz stopione sole przewodzą prąd elektryczny
Własności fizyczne soli
Sole mogą mieć inną barwę niż białą, np.:
niebieska - CuSO4 * 5H2O
żółtej - PbI2 czerwona - HgI2
czarna - CuS
Rozpuszczalność soli w wodzie jest bardzo zróżnicowana, zależna od kationu i anionu.
Dobrze rozpuszczalne są np. azotany(V), chlorki czy sole sodu, potasu i amonu.
Istnieje także duża ilość soli trudno rozpuszczalnych, czyli, takich które nawet z roztworów rozcieńczonych strącają się w postaci osadów.
Do tego typu substancji należą:
chlorki AgCl , PbCl2
bromki AgBr, PbBr2
jodki AgI , PbI2
fluorki CaF2
siarczany BaSO4 , PbSO4
azotany (III) AgNO2
wszystkie siarczany, węglany i fosforany z wyjątkiem soli litowców i amonu
wszystkie siarczki z wyjątkiem soli litowców, berylowców i amonu
Podział soli
Podział soli ze względu na obecność tlenu w reszcie kwasowej: tlenowe - pochodne od kwasów tlenowych Przykłady: siarczany (VI) Na2SO4, MgSO4 azotany (V) AgNO3, KNO3 beztlenowe - pochodne od kwasów beztlenowych
Przykłady: chlorki AgCl, NaCl jodki KI, MgI2 siarczki Na2S, CaS
Podział soli ze względu na złożoność budowy:
Sole proste to sole zawierające jeden rodzaj kationów i jeden rodzaj anionów:
Przykłady: MgCO3 Na2S Na2SiO4
Sole podwójne mogą zawierać dwa rodzaje kationów lub dwa rodzaje anionów:
Przykłady: MgAl2(SO4)4 Pb2Cl2CO3
Sole wielokrotne zawierają trzy i więcej kationów lub anionów, są to na ogół minerały:
Przykład: CaNaCu5Cl(AsO4)4
Podział soli ze względu na charakter chemiczny: Sole obojętne o ogólnym wzorze: MnRm Przykład: Al2(SO4)3 Wodorosole ( "sole kwaśne") o wzorze ogólnym: Mn( Hk R)m Składają się z metalu oraz reszty kwasowej, w skład której wchodzi " zwykła " reszta kwasowa oraz atom (atomy) wodoru. H2SO4 + 2NaOH = Na2SO4 + 2H2O sól obojętna H2SO4 + 2NaOH = NaHSO4 + H2O wodorosól
Przykłady: NaHCO3 wodorowęglan sodu
Ca(H2PO4)2 wodorofosforan (V) wapnia
Hydrosole ( "sole zasadowe ", sole wodorotlenkowe ) o wzorze ogólnym: M ( OH )knRm
Składają się one z reszty kwasowej R oraz z tzw : reszty zasadowej , w skład której wchodzi metal i jedna lub kilka grup OH . Mg ( OH )2 + 2HCl = MgCl2 + 2H2O sól obojętna Mg ( OH )2 + HCl = Mg ( OH ) Cl + H2O hydrosól
Przykład: [Cu(OH)]2CO3 węglan hydroksomiedzi (II) Istnieją także sole uwodnione zwane inaczej hydratami.
Związki tego typu posiadają wbudowane w sieć krystaliczną cząsteczki wody.
Przykłady: CuSO4 * 5H2O, CaSO4 * 2H2O (gips)
Właściwości chemiczne soli:
sole rozpuszczalne w wodzie są mocnymi elektrolitami,
utworzone jony ulegają hydratacji (otaczają się cząsteczkami wody)
ulegają hydrolizie, z wyjątkiem soli mocnych zasad i mocnych kwasów
niektóre sole rozkładają się podczas ogrzewania: 2KClO3 = 3O2 + 2KCl
Otrzymywanie
Istnieje wiele sposobów otrzymywania soli.
Poniżej przedstawiono niektóre z nich:
1. zasada + kwas = sól + woda
Przykład: NaOH + HCl = NaCl +H2O 3Mg (OH)2 + 2H3PO4 = Mg3 (PO4)2 + 6H2O
W procesie tym anion wodorotlenkowy z wodorotlenku reaguje z kationem wodorowym kwasu z utworzeniem obojętnej cząsteczki wody. Jest to jedna z najważniejszych reakcji prowadząca do utworzenia soli.
2. metal + kwas = sól + wodór
Przykład: Zn + 2HCl = ZnCl2 +H2
3. tlenek metalu + kwas = sól + woda
Przykład: CuO + H2SO4 = CuSO4+H2O
4. zasada + bezwodnik kwasowy = sól + woda
Przykład: Ca(OH)2 + CO2 = CaCO3 + H2O
5.bezwodnik zasadowy + bezwodnik kwasowy = sól
Przykład: MgO + SO2 = MgSO3
6.metal + niemetal = sól
Przykład: 2Na + Cl2 = 2NaCl
W ten sposób tworzą się sole kwasów beztlenowych.
Przegląd soli
Sole są substancjami bardzo rozpowszechnionymi w przyrodzie. Stanowią główny składnik, obok tlenków, skorupy ziemskiej. Występują także w wodzie morskiej w postaci jonów soli np.: Na+, K+, Mg2+, Cl-, SO42-. Wiele soli to kopaliny, wydobywane z ziemi metodami górniczymi. Najważniejszą taka solą jest chlorek sodu - sól kamienna. Wydobywa się go w Polsce głównie w okolicy Wieliczki, Bochni i Inowrocławia. Sól kamienna zawiera niewielkie ilości bromków i jodków sodu oraz potasu.
Wiele soli występuje w postaci minerałów:
CaCO3 - węglan wapnia - główny składnik wapienia i marmuru (również kredy)
MgCO3 * CaCO3 - dolomit - stosowany jako kamień budowlany, topnik w metalurgii i składnik materiałów ceramicznych
NaNO3 - saletra chilijska,
KNO3 - saletra indyjska
Ca(NO3)2 - saletra wapniowa
Ca3(PO4)2 - fosforan wapnia - stanowiący główny składnik fosforytów i apatytów
CaSO4 * 2 H2O - siarczan wapnia, czyli gips
Sole maja bardzo liczne zastosowania, np.
jako nawozy sztuczne,
w budownictwie (CaCO3 i CaSO4),
w komunikacji do zabezpieczania dróg przed zamarzaniem ( NaCl i CaCl2 ),
w przemyśle spożywczym ( NaCl i NaNO3 jako konserwanty )
oraz wiele innych.
Azotany (V) i (III)
Sole te są substancjami krystalicznymi, zwykle bezbarwnymi, dobrze rozpuszczalnymi w wodzie. Podczas ogrzewania powyżej temperatury topnienia rozkładają się z wydzieleniem tlenu, dlatego mają silne właściwości utleniające. Azotany stosuje się jako nawozy mineralne, materiały wybuchowe lub ich składniki, w lecznictwie, w fotografii. Występują one w przyrodzie jako minerały: nitratyn, nitryt. Azotan (V) sodu, NaNO3 , nitratyn, saletra sodowa, saletra chilijska
Własności fizyczne
bezbarwna substancja krystaliczna temperatura topnienia 309C dobrze rozpuszczalny w wodzie
Właściwości chemiczne
Podczas ogrzewania, powyżej temperatury topnienia rozkłada się na azotyn sodowy i tlen : 2 NaNO3 = 2 NaNO2 + O2
Występowanie
Jako minerał tworzy się na obszarach o suchym i gorącym klimacie. Największe złoża wystepują w Chile oraz na pustyni Atakama, a także w Kazachstanie, w Indiach, Peru i Boliwii, w Egipcie, Hiszpanii i U.S.A.
Otrzymywanie
Saletrę sodową otrzymuje się na skalę przemysłową w reakcji : 2 HNO3 + Na2CO3 ą 2 NaNO3 + H2O + CO2 lub stosując roztwór sody do końcowej absorpcji w instalacjach wytwarzających kwas azotowy.
Zastosowanie
jako nawóz sztuczny w przemyśle szklarskim
- jako utleniacz w reakcjach
w fazie stałej w przemyśle spożywczym jest dodawany do konserw mięsnych,
stosowany do produkcji materiałów wybuchowych i pirotechnicznych, barwników,
jako utleniacz stałych paliw rakietowych
Azotan (V) potasu, KNO3 , nitryt, saletra potasowa, saletra indyjska
Własności fizyczne
bezbarwny lub białawy ( ew. szarawy )
łatwo rozpuszczalny w wodzie o słonym smaku
Występowanie
Jego złoża tworzą się na obszarach o suchym i gorącym klimacie, głównie w Indiach, także w Chile (jako domieszka w złożach nitratynu ), Boliwii i Peru.
Otrzymywanie
Saletrę potasową otrzymuje się z saletry sodowej w reakcji: NaNO3 + KCl = KNO3 + NaCl.
Otrzymuje się z niej również KNO2.
Zastosowanie
jako nawóz sztuczny
w konserwacji mięsa
jako utleniacz
do produkcji barwników
Azotan (V) wapnia, Ca(NO3)2, saletra wapniowa
Własności fizyczne
bezbarwne kryształy bardzo dobrze rozpuszczalny w wodzie higroskopijny temperatura topnienia 561 oC
Występowanie:
W przyrodzie występuje w niewielkich ilościach. Nazywa się go również saletrą norweską.
Otrzymywanie
Saletrę wapniową produkuje się w procesie : CaCO3 + 2 HNO3 = Ca(NO3)2 + H2O + CO2
Zastosowanie
Używany jest przeważnie jako nawóz mineralny w postaci saletry, saletrzaku.
Azotan (V) srebra, AgNO3,
nazwa farmaceutyczna - Lapis
Własności fizyczne
bezbarwna substancja krystaliczna temperatura topnienia 208,6C
dobrze rozpuszczalna w wodzie, alkoholach, acetonie, pirydynie
działa żrąco na skórę
Właściwości chemiczne
Łatwo ulega redukcji do metalicznego srebra
Otrzymywanie
Otrzymywany poprzez działanie kwasu azotowego HNO3 na metaliczne srebro, w obecności kwasu azotowego (III) HNO2.
Zastosowanie w chemii analitycznej do produkcji luster
w materiałach fotograficznych
jako środek odkażający do uzdatniania wody
Azotan amonu, NH4NO3, saletra amonowa
Własności fizyczne bezbarwna substancja krystaliczna rozpuszczalna w wodzie
Właściwości chemiczne
jest środkiem utleniającym ogrzewany rozkłada się gwałtownie ( wybucha )
Otrzymywanie
Tworzy się w wyniku działania na kwas azotowy HNO3 amoniaku NH3: NH3 + HNO3 = NH4NO3
Zastosowanie jako nawóz sztuczny (w mieszaninach, ponieważ sam jest za bardzo higroskopijny)
przy produkcji materiałów wybuchowych i pirotechnicznych
jako pożywka dla kultur drożdży do wyrobu antybiotyków
Węglany
Sole te występują w postaci krystalicznej, zwykle są białe lub bezbarwne, trudno rozpuszczalne w wodzie (najtrudniej BaCO3, CaCO3, SrCO3 ), z wyjątkiem węglanów litowców i na ogół węglanów kwaśnych. Wodne roztwory węglanów wykazują odczyn zasadowy, ponieważ hydrolizują. Łatwo reagują nawet ze słabymi kwasami z utworzeniem soli i wydzieleniem CO2. Węglany kwaśne są nietrwałe, podczas ogrzewania przechodzą w obojętne, natomiast większość obojętnych ulega rozkładowi na tlenek metalu i CO2. Bez rozkładu można stopić jedynie węglany potasowców. Sole te występują bardzo często w przyrodzie jako minerały skałotwórcze. Węglany stanowią surowce do otrzymywania metali: smitsonit cerusyt rodochrozyt syderyt
Stosuje się je miedzy innymi:
w przemyśle optycznym ( kalcyt),
do wyrobu farb ( malachit, azuryt ),
do wyrobu materiałów ogniotrwałych (magnezyt),
a także syntetyczny węglan sodu.
Wodorowęglany służą głównie do przygotowania roztworów buforowych (roztworów o stałej wartości Ph ).
Węglan magnezu, MgCO3 Własności fizyczne bezbarwna substancja krystaliczna może być szary, brunatny lub żółtawy zwykle tworzy skupienia gruboziarniste może występować również w formie zbitej (magnezyt bezpostaciowy) jest rozpuszczalny w wodzie nierozpuszczalny w rozpuszczalnikach organicznych
Właściwości chemiczne
W temperaturze ok. 500oC ulega rozkładowi na tlenek magnezu MgO i CO2.
Występowanie
Węglan magnezu jest rozpowszechniony w naturze i występuje jako magnezyt oraz dolomit. Złoża magnezytu ziarnistego występują na Uralu, w Czechach, Austrii. Magnezyt zbity, będący produktem wietrzenia zasadowych skał magmowych, występuje w postaci żył i gniazd wśród serpentynów w U.S.A. (Kalifornia), Grecji ( wyspa Eubea), a w Polsce - na Dolnym Śląsku (okolice Sobótki, Braszowic, Grochowej ).
Dolomit może występować w formie zbitej, ziarnistej lub porowatej. W Polsce występuje na Górnym i Dolnym Śląsku, w Górach Świętokrzyskich, Tatrach, w okolicach Krakowa.
Zastosowanie
magnezyt ziarnisty - surowiec do uzyskiwania magnezu, do wyrobu materiałów ogniotrwałych, cementu Sorela, w przemyśle farb i lakierów (jako biały pigment), izolatorów elektrycznych, oraz w przemyśle chemicznym, szklarskim i papierniczym, w medycynie jako środek przeczyszczający oraz zobojętniający nadmiar kwasu żołądkowego dolomit - Używany w budownictwie, do wyrobu materiałów ogniotrwałych, cementu, szkła, w metalurgii, w przemyśle chemicznym
Węglan sodu, Na2CO3, soda
Własności fizyczne
występuje w postaci bezwodnej (jako tzw. Soda amoniakalna lub kalcynowana) biały, krystaliczny, higroskopijny proszek rozpuszczalny w wodzie temperatura topnienia 852oC
Właściwości chemiczne
w rozcieńczonych kwasach mineralnych ulega rozpuszczeniu z wydzieleniem dwutlenku węgla tworzy hydraty, z których najważniejszy jest dziesięciohydrat Na2CO3 * 10 H2O, tzw. soda krystaliczna, bezbarwne kryształy, które podczas ogrzewania tracą wodę przechodząc w temperaturze 100C w sól bezwodną roztwory wodne węglanu sodowego mają odczyn zasadowy
Występowanie
Węglan sodu występuje w przyrodzie w postaci minerał natryt. Spotykany w przyrodzie w jeziorach sodowych w Afryce i w Ameryce.
Otrzymywanie
Węglan sodu na skalę przemysłową otrzymywano dawniej metodą Leblanca, polegającą na działaniu kwasem siarkowym H2SO4 na chlorek sodu NaCl (sól kamienna), a następnie prażono powstały siarczan w obecności węgla i węglanu wapnia aż do uzyskania sody. Obecnie węglan sodu otrzymuje się metodą Solraya (zwaną także metodą amoniakalną). Polega ona na wprowadzeniu amoniaku i dwutlenku węgla do nasyconego roztworu chlorku sodu i wytrąceniu wodorowęglanu sodu NaHCO3. Potem poddaje się go prażenia (inaczej kalcynowania), podczas którego przechodzi on w obojętny węglan sodu.
Zastosowanie
stosowany do otrzymywania szkła środków piorących i myjących wodorotlenku i azotanu sodu innych soli sodowych w przemyśle włókienniczym i papierniczym do zmiękczania wody w hutnictwie (odsiarczanie żelaza ) jako odczynnik chemiczny w farbiarstwie i garncarstwie
Węglan wapnia, CaCO3
Własności fizyczne
biała substancja krystaliczna kalcyt jest bezbarwny i przezroczysty ( szpat islandzki ) lub zabarwiony, głównie na żółtawo lub brunatnawo aragonit - bezbarwny, białawy lub żółtawy, w normalnych warunkach nietrwały, z biegiem czasu przechodzi w kalcyt słabo nierozpuszczalny w wodzie nierozpuszczalny w rozpuszczalnikach organicznych w atmosferze nasyconej CO2 i pod wysokim ciśnieniem topi się w temperaturze ok. 1300oC
Właściwości chemiczne
Ogrzany do temperatury 900C rozkłada się na tlenek wapniowy CaO ( wapno palone ) i CO2
Występowanie
Występuje w przyrodzie w postaci minerałów : kalcytu i aragonitu. Kalcyt jest szeroko rozpowszechniony w przyrodzie, jako składnik wielu skał osadowych (wapienie, margle), w których występuje jako produkt sedymentacji chemobiogenicznej ( buduje szkielety wielu organizmów ) i chemicznej. Występuje w marmurach, wapieniach. Powstaje wskutek procesów hydrotermalnych. Aragonit jest pospolitym składnikiem skorup i szkieletów organizmów współczesnych, głównym składnikiem pereł. Może powstawać wskutek procesów hydrodermalnych, krystalizuje z wód gorących źródeł (np. w Karlowych Warach) albo tworzy nacieki w jaskiniach. W Polsce występuje na Górnym i Dolnym Śląsku.
Otrzymywanie
Najczęściej stosuje się naturalny węglan wapnia. Można go otrzymać także przez działanie dwutlenkiem węgla na roztwór wodorotlenku wapnia: Ca(OH)2 + CO2 = CaCO3 + H2O Zastosowanie kalcyt - w postaci szpatu islandzkiego do wytwarzania przyrządów optycznych w budownictwie (wapień, marmur) jako surowiec do otrzymywania wapna palonego (wapień) kreda mielony i strącany węglan wapnia są używane w budownictwie, jako napełniacz gumy, papieru, linoleum, składnik pasty do zębów Węglan żelaza (II), FeCO3, syderyt Własności fizyczne
białawy, żółtawy, szarawy lub brunatny kruchy
Występowanie
W przyrodzie występuje w postaci minerału syderytu.
Powstaje wskutek procesów hydrotermalnych, ale również jako produkt metasomatozy innych węglanów. Często osadza się też w wodnych środowiskach redukujących (np. w zatokach morskich, lagunach czy zbiornikach słodkowodnych ). Jest głównym składnikiem osadowych skał żelazistych (sfero syderyt, syderyt) oraz odlitowanych rud żelaza. Złoża węglanu żelaza (II) występują na Półwyspie Kerczeńskim, Uralu, Austrii (Eisnerz), Hiszpanii (Bilbao), Wielkiej Brytanii (Cumberland), U.S.A., a w Polsce w dużych ilościach na obszarze częstochowskim (od Żarek przez Poraj, Częstochowę do Wielunia), radomskim (m.in. okolice Opatowa, Starachowic) oraz w okolicy Łęczycy. W mniejszych ilościach w Karpatach i na Górnym Śląsku.
Węglan cynku, ZnCO3, smitsonit
Własności fizyczne
Jest biały, szary, żółtawy lub brunatnawy
Występowanie
Węglan cynku występuje w postaci minerału. Powstaje w strefie utleniania siarczkowych złóż ołowiowo-cynkowych występujących w skałach węglanowych np. w Rosji (m.in. okręg nerczyński), U.S.A. (Kolorado), Grecji (Laurion). Tworzy galman, rudę cynku wraz z hemimorfitem.
Zastosowanie
Używa się go do otrzymywania metali.
Węglan miedzi, Cu(CO3)2 (OH)2, azuryt
Własności fizyczne
Jest on niebieski
Występowanie
Występuje w postaci minerału - azurytu. W przyrodzie powstaje w strefie utleniania złóż rud miedzi. W Polsce występuje m.in. w G. Świętokrzyskich, w Tatrach.
Zastosowanie
jako materiał dekoracyjny do wyrobu farb
Węglan miedzi, Cu2[CO3][OH]2 , malachit
Własności fizyczne
zielony, daje się polerować
Występowanie
Związek ten występuje w przyrodzie w postaci minerału - malachitu. Występuje w strefie utleniania złóż rud miedzi, a największa jego ilość na Uralu (złoża Miednorudniańskie i Gumiszewskie). W Polsce wydobywany był w Górach Świętokrzyskich.
Zastosowanie jako kamień dekoracyjny (od czasów starożytnych) do produkcji farb do otrzymywania miedzi
Fosforany
Fosforany występują w przyrodzie jako fosforyty i apatyty (ortofosforan(V) sodu Na3PO4 ). Stosowane są one do produkcji sztucznych nawozów fosforowych oraz jako składnik proszków, płynów do mycia naczyń i zmiękczania wody.
Ortofosforan(V) sodu(Na2HPO4), natomiast, jako środek obciążający przy ognioodpornej impregnacji tkanin oraz dodatek do wyrobu szkieł optycznych.
Fosforan(V) wapnia, Ca3(PO4)2
Występowanie
Fosforan(V) wapnia występuje w skałach osadowych wraz z domieszką kwarcu, glaukonitu, pirytu, kalcytu, substancji bitumicznych to fosforyty. Zawierają one od 15 do 40% P2O5. Pochodzenie ich jest często organiczne, tworzą się w niezbyt głębokim morzu. Fosforyty można wydobywać w: U.S.A. (zwłaszcza na Florydzie), Ukraina, Maroko, Tunezja, Mauretania, a w Polsce w północno-wschodnich Górach Świętokrzyskich, okolicach Rachowa.
Zastosowanie
jako surowiec do produkcji nawozów fosforowych (superfosforat) do produkcji fosforu, żelazofosforu, kwasu fosforowego i jego soli zmielone fosforyty (głównie niskoprocentowe) stanowią nawóz mineralny (mączka fosforowa)
Apatyty
Własności fizyczne
Mogą mieć różne kolory: szarawozielone, zielone, żółte lub niebieskawe, a czasami nawet brunatne lub fioletowe.
Występowanie
Minerały pochodzą od fosforanu wapnia. Mogą także zawierać również inne grupy: CO3, SO4, SiO4. Mają pochodzenie osadowe, a występują głównie w postaci mieszanin ( np. frankolit, kolofan, dalit ) jako główne składniki fosforytów. Apatyty krystalizują w układzie heksagonalnym.
Zastosowanie do otrzymywania fosforowych nawozów sztucznych (superfosforatu i precypitatu) do przemysłowej produkcji kwasu fosforowego i jego soli oraz ubocznych związków fluoru
Fosforany te znajdują się w większości skał magmowych stanowiąc główne źródło fosforu w przyrodzie. Występują w skałach metamorficznych i osadowych. Główne złoża to: na Półwyspie Kola, w otoczeniu Jeziora Bajkał, w północnej Afryce, w U.S.A., a w Polsce spotykane sporadycznie. Fosforyty powstają w wyniku wietrzenia i przemian biochemicznych apatytu.
Siarczki
Mogą występować w postaci soli obojętnych lub kwaśnych. Są substancjami krystalicznymi, często barwnymi, słabo lub bardzo słabo rozpuszczalnymi (z wyjątkiem siarczków litowców i wodorosiarczków) w wodzie. Posiadają właściwości redukujące. Siarczki występują powszechnie w przyrodzie w postaci minerałów (np. piryt, galena, sfaleryt, cynober, antymonit, chalkopiryt, chalkozyn), które stanowią surowiec do otrzymywania metali oraz dwutlenku siarki.
Używa się ich jako reduktory, do wyrobu farb i litoponów oraz w ceramice.
Siarczek rtęci ( II ), HgS
Własności fizyczne substancja krystaliczna nierozpuszczalny w wodzie rozpuszczalny w wodzie królewskiej i siarczkach metali alkalicznych silnie trujący
Właściwości chemiczne
Czarny siarczek rtęci łatwo strąca się z roztworów soli rtęciowych pod działaniem siarkowodoru.
Jest nietrwały, dosyć łatwo przechodzi w trwałą odmianę czerwoną na wskutek przemiany monotropowej.
Siarczek ten ulega rozpuszczeniu w stężonych roztworach siarczków metali alkalicznych z utworzeniem tiosoli: HgS + K2S = K2[ HgS2 ] dwutiortęcian potasowy
Podczas reakcji strącania siarczku rtęci siarkowodorem mogą powstać czasem osady o innym zabarwieniu niż czarny.
Tworza się wtedy chlorosiarczki : 3HgCl2 + K2S = Hg3S2Cl2 + 4 HCl
Osady mogą mieć zabarwienie białe, żółte, brązowe.
Występowanie
Siarczek rtęci występuje pod dwoma postaciami: czarnej i czerwonej. W naturze można go spotkać jako minerał cynober (czerwony), który jest podstawowym źródłem rtęci.
Jego główne złoża znajdują się w Hiszpanii (Almaden), Włoszech ( Monte Amiata w Toskanii ) i w byłej Jugosławii ( Idrija ).
Zastosowanie
Używany jest jako pigment do produkcji farb i jako katalizator.
Siarczek żelaza ( II ), FeS
Własności fizyczne
czarna substancja krystaliczna nierozpuszczalny w wodzie
Właściwości chemiczne
Ulega rozpuszczeniu w kwasach z wydzieleniem siarkowodoru.
Występowanie W przyrodzie występuje jako minerały: pirotyn i trolit, który można spotykać w meteorytach.
Piryt magnetyczny (inna nazwa pirotynu) ma zabarwienie brązowożółte, charakteryzuje się metalicznym połyskiem i kruchością.
W największej ilości występuje w zasadowych skałach magmowych (gabra, noryty).
Jego złoża zlokalizowane są w Kanadzie (Sudbury w Ontario) i R.P.A. (Transwal), a w Polsce - na Dolnym Śląsku (m.in. okolice Lubania, Miedzianki, Kowar).
Zastosowanie
Siarczek żelaza ( II )
ma zastosowanie w laboratoryjnym otrzymywaniu siarkowodoru.
Siarczek żelaza ( IV ), FeS2
Własności fizyczne
żółta substancja krystaliczna nierozpuszczalna w wodzie
Występowanie
Występuje jako minerały : piryt i markazyt. Piryt najczęściej zawiera domieszki srebra i złota. Ma barwę mosiężnożółtą, o silnym połysku metalicznym, jest kruchy. Stanowi on najpowszechniejszy siarczek w skorupie ziemskiej. Może powstać w różnych warunkach, przede wszystkim w złożach hydrotermalnych i kontaktowo - metasomatycznych. Duże złoża pirytu znajdują się w Hiszpanii (Minas de Riotinto), Portugalii, Norwegii (Trondheim), Japonii (Honsiu), na Uralu, Kaukazie, w Niemczech i we Włoszech, a w Polsce w Rudkach koło Nowej Słupi, Wieściszowice na Dolnym Śląsku.
Markazyt , drugi z minerałów ma zabarwienie także mosiężnożółte, ale wykazuje zielony odcień.
Można spotkać go w żyłach hydrotermalnych (tam tworzy się w niskich temperaturach) a także w skałach osadowych (iłach, łupkach ilastych i węglach).
Duże ilości tego minerału znajdują się na południowym Uralu (złoże Bławińskie), a w Polsce , podobnie jak piryt, w Rudkach koło Nowej Słupi.
Zastosowanie
Piryt i markazyt są głównym surowcem do produkcji kwasu siarkowego.
Siarczek srebra, Ag2S
Własności fizyczne
ołowianoszare kryształy nierozpuszczalny w wodzie topi się powyżej 840oC
Właściwości chemiczne
Ulega rozpuszczeniu w gorącym kwasie azotowym (V).
Występowanie
W naturze można go spotkać w postaci minerału argentytu.
Posiada on zabarwienie ołowianoszare lub czarne, wykazuje kowalność, jest produktem procesów hydrotermalnych. Jego największe złoża są w Norwegii, Meksyku, a w Polsce niewielkie ilości - na Dolnym Śląsku (np. w Kowarach).
Zastosowanie
stosowany w grawerstwie (srebro pokryte warstewką siarczku nazywane jest oksydowanym )
do wyrobu filtrów optycznych w alarmowej aparaturze pożarniczej
Siarczek ołowiu, PbS
Własności fizyczne
Ołowianoszary, często z odcieniem srebrzystym, o silnym połysku metalicznym kruchy odznacza się znakomitą łupliwością
Właściwości chemiczne
Siarczek ołowiu jest trudno rozpuszczalny w kwasach. PbS ulega strąceniu z roztworów soli ołowiowych pod wpływem kwasu siarkowodorowego H2S.
Występowanie
W przyrodzie występuje jako galena (galenit). Minerał ten zwykle przeważnie domieszki srebra. Posiada regularny układ krystaliczny. Tworzy się w źródłach hydrotermalnych (zazwyczaj ze sfalerytem, pirytem) i w skałach osadowych. Jego największe złoża występują w: U.S.A., Kanada, Rosja, Meksyk, Boliwia, Australia. W Polsce wydobywany jest w okolicy Bytomia, Olkusza i Chrzanowa, kiedyś również w Górach Świętokrzyskich, Tatrach i Sudetach.
Zastosowanie
Używany jest do otrzymywania srebra. Siarczek cynku, ZnS
Własności fizyczne
biała substancja krystaliczna sublimuje w temperaturze do 1200oC, pod ciśnieniem 15 MPa
topi się w temperaturze 1850oC
nierozpuszczalny w wodzie
Właściwości chemiczne
nierozpuszczalny w słabych kwasach organicznych
reaguje z mocnymi kwasami z wydzieleniem siarkowodoru
Występowanie
Można spotkać go w postaci minerałów: sfalerytu i wurcytu. Sfaleryt zawiera domieszki żelaza, manganu, kadmu, galu, talu. Posiada zabarwienie miodowożółte, brunatne lub czarne. Jest składnikiem źródeł hydrotermalnych (zprzeważnie z galenitem, pirytem) i skał osadowych. Występuje w: U.S.A. (Tri States District), Kanada ( Kolumbia Brytyjska), Kaukaz, Polska (obszar śląsko - krakowski), Algieria, Tunezja. Ruda ta jest najbogatszą z rud cynku, stanowi surowiec do otrzymywania takich metali jak: Ga,Cd. Drugi z minerałów wurcyt jest mniej trwały, a w przyrodzie występuje znacznie rzadziej. Posiada barwę brunatną lub ciemnobrunatną. Stanowi składnik złóż hydrotermalnych, najczęściej z sfalerytem.
Główne złoża to: na Uralu, w U.S.A. (Montana), Boliwii (Oruro), a w Polsce można go wydobywać w okolicach Bytomia.
Zastosowanie
jako syntetyczny siarczek cynku ma zastosowanie do wyrobu pigmentu: litoponu,
jest to substancja nietoksyczna, ma dobrą zdolność kryjącą
siarczek ten z domieszką soli miedzi lub srebra używany jest do pokrywania ekranów w kineskopach,
jako scyntylator do pomiaru promieniowania jonizującego
w analizie chemicznej służy do oddzielania oraz odznaczania cynku
Siarczek miedzi ( I ), Cu2S
Własności fizyczne
topi się w temperaturze 1130C
posiada strukturę antyfluorytu
Właściwości chemiczne
Wykazuje większą trwałość niż siarczek miedzi (II) CuS
Występowanie
W przyrodzie jest głównym składnikiem minerału chalkozynu. Jego złoża znajdują się w U.S.A. (Alaska, Arizona, Montana).
Otrzymywanie
Otrzymuje się go działając na CuS wodorem w wyższej temperaturze.
Siarczek miedzi ( II ), CuS
Własności fizyczne
Posiada czarną barwę. Krystalizuje w układzie heksagonalnym. Ze względu na złożoność budowy określono jego wzór jako: Cu2CuS3.
Właściwości chemiczne
reaguje z kwasem azotowym łatwo rozpuszcza się w wielosiarczkach alkalicznych
Otrzymywanie
Można otrzymać go przez nasycenie siarkowodorem roztworów soli miedzi.
Siarczek antymonu, Sb2S3
Własności fizyczne
postać krystaliczna
pomarańczowa barwa
Występowanie
W przyrodzie występuje jako minerał: antymonit. Posiada on barwę ołowianoszarą. Powstaje na skutek procesów hydrotermalnych. Wydobywa się go: w Japonii, w Chinach, w Algierii, w Rosji, a w Polsce występuje w bardzo małych ilościach na Dolnym Śląsku i w Pieninach.
Zastosowanie w
produkcji zapałek
do wulkanizacji
do barwienia kauczuku
Siarczek miedzi i żelaza, CuFeS2, chalkopiryt
Własności fizyczne
Ma kolor mosiężnożółty.
Występowanie
Występuje w przyrodzie w postaci chalkopirytu dość pospolicie. Stanowi składnik wszystkich typów skał. Wydobywa się go w: Zambii, Zairze, Chile, U.S.A., a w Polsce głównie w powiecie kieleckim i na Dolnym Śląsku. Siarczek wapnia, CaS
Własności fizyczne
biała substancja krystaliczn
a trudno rozpuszczalna w wodzie
temperatura topnienia >2000oC
wykazuje fosforescencję
Zastosowanie
jako depilator w garbarstwie i kosmetyce
do produkcji cieczy kalifornijskiej
do wyrobu farb świecących
Siarczek sodu, Na2S
Własności fizyczne
bezbarwne kryształy rozpuszczalne w wodzie
silnie higroskopijne
temperatura topnienia 1180oC
Właściwości chemiczne
tworzy hydrat Na2S * 9 H2O siarczku sodu
reaguje z siarką z utworzeniem polisiarczku sodu
barwy żółtej
Zastosowanie
jako środek redukujący
odczynnik chemiczny w garbarstwie do usuwania sierści ze skór do wyrobu barwników siarkowych
Chlorki
Są solami krystalicznymi, za wyjątkiem chlorków niektórych metali ciężkich (np.AgCl) rozpuszczonych w wodzie.
W stanie stopionym lub w roztworze przewodzą prąd elektryczny. Chlorki sodu i potasu występują w przyrodzie tworząc złoża. Duże ich ilości rozpuszczone są w wodzie morskiej (np. magnezowy i sodowy). Duże znaczenie mają, oprócz już wymienianych, chlorki amonu, antymonu, cynku, cyny, rtęci, srebra, wapnia, żelaza. Istnieją także chlorki niemetali np.: fosforu, siarki, czterochlorek węgla, krzemu wykazujące inny charakter i właściwości: są to ciała stałe lub ciecze nie wykazujące budowy jonowej.
Chlorek sodu, NaCl, sól kuchenna
Własności fizyczne
biała substancja krystaliczna
dobrze rozpuszczalna w wodzie
(nasycony roztwór zawiera 40,7g NaCl na 100g wody)
temperatura topnienia 801oC,
temperatura wrzenia 1453oC
Właściwości chemiczne
Sól kamienna
staje się plastyczna w podwyższonej temperaturze i pod zwiększonym ciśnieniem.
Występowanie
W przyrodzie występuje pospolicie w postaci minerału halitu. Stanowi podstawowy składnik soli kuchennej. Jego barwa jest zmienna: może być bezbarwny i przezroczysty lub biały, niebieski, żółtawy, czerwonawy. Jako kruchy wykazuje bardzo dobrą łupliwością kostkową. Halit powstaje w postaci zbitych mas w wyniku odparowywania mórz i słonych jezior. Chlorek sodu nie występuje samodzielnie, ale z gipsem, anhydrytem, czasem z chlorkami i siarczanami potasu i magnezu. Halit powstał w okresie permu i w erze trzeciorzędzie. Obecnie powstaje on w Morzu Kaspijskim. Może on również występować w postaci wysadów. Sól kamienna jest wydobywana w Niemczech, U.S.A., Rosji, Chinach, Francji, a w Polsce w środkowej i północno-zachodniej części państwa (Inowrocław, Wapno, Kłodawa) oraz na Podkarpaciu (Wieliczka i Bochnia). W naturze duże ilości tej soli występują w wodach morskich i mineralnych (solanki) oraz w organizmach żywych (szczególnie zwierząt).
Zastosowanie
surowiec m.in. do produkcji sody, wodorotlenku sodu, kwasu solnego, sodu i chloru
używany także w spektroskopii (kryształy)
w chłodnictwie (z lodem tworzy mieszaninę oziębiającą)
w lecznictwie (np. do roztworów fizjologicznych) jest dodatkiem do potraw i pasz (tzw. sól pastewna)
Chlorek potasu, KCl
Własności fizyczne
bezbarwna substancja krystaliczna
temperatura topnienia 775o C temperatura wrzenia ok. 1500oC
dobrze rozpuszczalna w wodzie
nierozpuszczalna w rozpuszczalnikach organicznych
Występowanie
Chlorek potasu w naturze występuje w postaci minerałów sylwinu (KCl) i karnalitu (KMgCl3 * 6 H2O), a także wchodzi w skład sylwinitu (K, Na)Cl.
Sylwin o słonawogorzkim smaku może przyjmować różne barwy do bezbarwnego przez białawy, żółtawy do czerwonawego.
Bardzo łatwo rozpuszcza się w wodzie. Tworzy się w morzach i słonych jeziorach poprzez odparowywanie.
Wydobywa się go w Niemczech (Stassfurt), Hiszpanii (Suria koło Barcelony), Francji (Alzacja), Rosji (Solikamsk), a w Polsce - w okolicach Kłodawy i Inowrocławia. Karnalit może także przyjmować różne barwy: bezbarwną, białą, żółtą czy czerwoną. Ta gorzka sól jest bardzo higroskopijna i bardzo łatwo rozpuszcza się w wodzie. Jego złoża znajdują się w Niemczech (Stassfurt), Rosji (Solikamsk), Hiszpanii (Suria koło Barcelony), U.S.A. (złoża nad Zatoką Meksykańską), a w Polsce najwięcej jego jest głównie w Kłodawie i Inowrocławiu.
Zastosowanie
sylwin - jako nawóz potasowy lub jako surowiec do produkcji związków potasu karnalit - do otrzymywania magnezu, soli potasowych, w lecznictwie, spektroskopii (jako monokryształy)
Chlorek wapnia, CaCl2
Własności fizyczne
bezbarwne kryształy rozpuszczające się w wodzie i alkoholu
silnie higroskopijne
temperatura topnienia 772oC
Zastosowanie
jako środek osuszający jako dodatek do cementów podczas robót zimowych do matowania włókien w lecznictwie jako środek przeciwko niedoborowi wapnia do wytwarzania mieszanin chłodzących
Chorek miedzi (I), CuCl
Własności fizyczne
bezbarwna substancja krystaliczna
temperatura topnienia 430 o C
temperatura wrzenia 1370 o C
trudno rozpuszczalny w wodzie
Właściwości chemiczne
ulega utlenieniu do zasadowego chlorku miedzi Cu(OH)Cl
na wilgotnym powietrzu amoniakalny roztwór chlorku miedzi (I) ma zdolność pochłaniania tlenku węgla CO, a wydziela po ponownym ogrzaniu
Zastosowanie
Używany do analizy gazów w chemii analitycznej. .
Chlorek miedzi (II), CuCl2
Własności fizyczne
brązowa substancja krystaliczna
temperatura topnienia 499 o C
temperatura wrzenia 993 o C
dobrze rozpuszczalny w wodzie
Właściwości chemiczne
Pod wpływem HCl następuje zmian zabarwienia z jasnoniebieskiego na zielone.
Zastosowanie
jako zaprawa przed farbowaniem tkanin jako katalizator w galwanotechnice w analizie gazów - stężony roztwór chlorku miedzi (II)
(ze względu na pochłanianie tlenku azotu (II) NO)
Chlorek amonu, NH4Cl, salmiak
Własności fizyczne
biała substancja krystaliczna dobrze rozpuszczalny w wodzie
Właściwości chemiczne
ogrzewanie powoduje rozkład związku na chlorowodór HCl i amoniak NH3
. roztwory wodne i gazowy chlorek amonu tworzą związki koordynacyjne z żelazem, miedzią
Otrzymywanie
Salmiak otrzymuje się w reakcji amoniaku z kwasem solnym (do reakcji można użyć także substratów gazowych) i jako produkt uboczny w otrzymywaniu sody metodą Solraya. Zastosowanie
jako nawóz sztuczny w tzw. suchych ogniwach Leclanchego do oczyszczania metali (np. przed lutowaniem)
w lecznictwie jako środek moczopędny
do produkcji klejów
w farbiarstwie
Chlorek cynku, ZnCl2
Własności fizyczne
białe, bardzo higroskopijne kryształy
rozpuszczalny w wodzie, alkoholu,
eterze,
glicerynie temperatura topnienia 319 o C
Zastosowanie
do oczyszczania metali przed lutowaniem
do odwadniania w syntezie organicznej
do drukowania tkanin (zaprawa)
do cynkowania jako mikronawóz
w lecznictwie jako środek przeciwzapalny (stosowany zewnętrznie) w postaci stężonych roztworów
Chlorek żelaza (II), FeCl2
Własności fizyczne
bezbarwna lub zielonkawoszara substancja krystaliczna silnie higroskopijna
temperatura topnienia 672 o C
temperatura wrzenia 1026 o C
dobrze rozpuszczalny w wodzie, alkoholach, acetonie
Właściwości chemiczne
roztwory wodne posiadają odczyn słabo kwaśny charakteryzuje się właściwościami słabo redukującymi tworzy rozpuszczalne w wodzie chlorokompleksy z chlorkami metali alkalicznych Otrzymywanie
Produkuje się go rozpuszczając żelazo w kwasie solnym.
Zastosowanie
w farbiarstwie (jako zaprawa przy barwieniu tkanin)
w przemyśle farmaceutycznym
w metalurgii jako substancja podstawowa do wytwarzania chlorku żelaza (III) FeCl3
jako reduktor
Chlorek żelaza (III), FeCl3
Własności fizyczne
zielone kryształy
temperatura topnienia 309 o C
sublimuje
temperatura wrzenia 319 o C
bardzo dobrze rozpuszczalny w wodzie, alkoholu, eterze
silnie higroskopijny
Właściwości chemiczne
tworzy hydraty (np. żółty FeCl3 * 6H2O)
tworzy kompleksy
w wodzie ulega hydrolizie
Otrzymywanie
Można go otrzymać w reakcji żelaza lub jego chlorku FeCl2 z chlorem.
Zastosowanie
w farbiarstwie (zaprawa) do produkcji farb i atramentu
do dezynfekcji wody
w syntezie organicznej jako łagodny środek utleniający
w hutnictwie (przerób rud miedzi i srebra)
w lecznictwie (do tamowania krwi)
do otrzymywania innych soli żelaza, pigmentu
jako katalizator Chlorek rtęci (II), HgCl2, sublimat
Własności fizyczne
bezbarwna substancja krystaliczna
słabo rozpuszczalna w wodzie
temperatura topnienia 277-280 o C
temperatura wrzenia 302 o C
silnie trujący
nie przewodzi prądu elektrycznego
Właściwości chemiczne
Wykazuje właściwości słabo kwaśne.
Otrzymywanie
Można otrzymać go w reakcji rtęci z nadmiarem chloru w podwyższonej temperaturze.
Zastosowanie
w medycynie jako środek dezynfekujący
w rolnictwie, jako ochrona roślin przed gryzoniami
w syntezie organicznej jako katalizator
do garbowania skór, barwienia tkanin
w fotografii (wzmacniacz)
w metalurgii
do produkcji ogniw i baterii rtęciowych
w litografii do otrzymywania Hg2Cl2
jako środek ochrony roślin
Chlorek rtęci, Hg2Cl2, kalomel
Własności fizyczne
biała substancja krystaliczna
bardzo trudno rozpuszczalna w wodzie
sublimuje bez stopienia w temperaturze 393 o C
nietrujący
Właściwości chemiczne
Dość łatwo ulega rozkładowi na chlorek rtęci (II) HgCl2 i rtęć pod wpływem światła i powyżej temperatury 400 o C.
Otrzymywanie
Otrzymywany bezpośrednio z chloru i rtęci lub przez ogrzewanie chlorku rtęciowego HgCl2 z rtęcią: HgCl2 + Hg = Hg2Cl2
Zastosowanie
jako środek ochrony roślin do wyrobu ogni sztucznych w elektrochemii do produkcji elektrod kalomelowych jako katalizator w lecznictwie jako zewnętrzny środek antyseptyczny (w chorobach skóry) i przeczyszczający (w lecznictwie weterynaryjnym)
Chlorek srebra, AgCl Własności fizyczne
biała substancja krystaliczna
nierozpuszczalny w wodzie
temperatura topnienia 457,7o C
temperatura wrzenia 1430o C
Właściwości chemiczne
tworzy kompleksy z amoniakiem, cyjankiem potasu, tiosiarczanem sodu pod wpływem światła rozkłada się z wydzieleniem srebra metalicznego (ciemnieje)
Występowanie
Można spotkać go w postaci minerału kerargirytu i chlorargirytu. Pierwszy z nich, kerargiryt, jest bezbarwny, plastyczny, pod wpływem światła ciemnieje (staje się szarobrnatny lub niemal czarny). Tworzy się w suchym i gorącym klimacie. Wydobywa się go w: Chile (Atacama), Boliwii, Peru, Meksyku, Australii, Uralu, Ałtaju.
Otrzymywanie
Otrzymuje się go w reakcji chlorku sodu z azotanem srebra.
Zastosowanie
jest składnikiem papierów i błon fotograficznych
(podczas procesu fotograficznego rozkłada się na srebro i chlor)
do srebrzenia
do malowania na szkle
otrzymywania metalicznego srebra w lecznictwie w fotografii w analizie chemicznej
Wspólnymi właściwościami soli są:
stały stan skupienia
budowa krystaliczna
kationy metali i aniony reszt kwasowych znajdują się w węzłach sieci krystalicznej
w stanie ciekłym przewodzą prąd elektryczny
są mocnymi elektrolitami
często są bezbarwne
charakteryzują się zróżnicowaną rozpuszczalnością w wodzie
ich roztwory mają odczyn obojętny.
: Wyślij Wiadomość.
Przetłumacz ten tekst na 91 języków
: Podobne ogłoszenia.
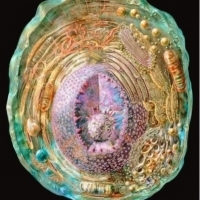
Ludzka komórka.
Ludzka komórka. Obrazek uzyskany za pomocą promieni rentgenowskich, magnetycznego rezonansu jądrowego i mikroskopii krioelektronowej. Foto: Russell Kightley/ Science
NOTECSYSTEM. Producent. Materiały ogniotrwałe.
Firma NOTEC-SYSTEM Nowoczesne Technologie Ceramiczne s.c. w swojej ofercie przedstawiamy bogaty wybór produktów i rozwiązań ceramicznych czołowych producentów krajowych i zagranicznych. Jesteśmy firmą rodzinną z wieloletnią tradycją, a dzisiejsza oferta…
MAWI. Producent. Urządzenia chłodnicze.
Mawi to istniejący od 1989 roku producent urządzeń chłodniczych i gastronomicznych, uznany zarówno w Polsce, jak i Europie. Produkcja wyrobów odbywa się przy użyciu materiałów i podzespołów najwyższej jakości, których producentami są wybitne światowe…
BioNTech, moderna, curevac, kovid-19, coronavirus, ваксина:
BioNTech, moderna, curevac, kovid-19, coronavirus, ваксина: 20200320AD BTM Innovations, шарикии давлат ва бахши хусусӣ, Apeiron, SRI International, Iktos, доруҳои вирусӣ, AdaptVac, ExpreS2ion Биотехнология, pfizer, janssen, sanofi, 16 март Комиссияи…
DEFRAME. Producent. Soczewki do okularów. Okulary przeciwsłoneczne.
Wszystkie soczewki okularów przeciw-słonecznych opatrzonych logiem DEFRAME posiadają polaryzację dzięki czemu niwelują szkodliwe dla oczu światło, a widziane kolory są prawdziwe i żywe. Soczewki te są również pozbawione największej wady, jaką jest…
Płytki podłogowe: gres szkliwiony szary
: Nazwa: Płytki podłogowe: : Model nr.: : Typ: nie polerowana : Czas dostawy: 96 h : Pakowanie: Pakiet do 30 kg lub paleta do 200 kg : Waga: 23 kg : Materiał: : Pochodzenie: Polska . Europa : Dostępność: detalicznie. natomiast hurt tylko po umówieniu :…
Matšoao a lefu la flu: Litsela tsa ts'oaetso ea ntaramane le mathata:
Matšoao a lefu la flu: Litsela tsa ts'oaetso ea ntaramane le mathata: Influenza ke bokuli boo re bo tsebileng ka lilemo tse ngata, bo ntse bo le teng ka nako ea selemo bo ka re khaola maotong kapele mme ka nako e telele bo re qheletse thoko mesebetsing…
फ्लू लक्षण: इन्फ्लूएन्जा संक्रमण र जटिलताको विधिहरू:6
फ्लू लक्षण: इन्फ्लूएन्जा संक्रमण र जटिलताको विधिहरू: इन्फ्लुएन्जा एक रोग हो जुन हामी सहस्राब्दीका लागि चिनिन्छौं, अझै मौसमी सम्बन्धमा यसले हाम्रो खुट्टा तुरुन्तै काट्न सक्छ र लामो समय सम्म हामीलाई व्यावसायिक क्रियाकलापबाट अलग गर्दछ। ईसापूर्व चौथो…
Hoe drink je water? Hoeveel water is er per dag nodig in relatie tot lichaamsgewicht.
Hoe drink je water? Hoeveel water is er per dag nodig in relatie tot lichaamsgewicht. Hier zijn drie eenvoudige stappen om de benodigde hoeveelheid water te bepalen: • De benodigde hoeveelheid water is afhankelijk van het gewicht. In principe wordt…
ملابس مثالية لمناسبة خاصة:
ملابس مثالية لمناسبة خاصة: فعل كل واحد منا هذا: حفل زفاف قادم ، تعميد ، حفل ما ، يجب أن نرتدي ملابس مناسبة ، لكن بالطبع لا يوجد شيء نفعله. نذهب إلى المتجر ، نشتري ما هو وليس ما نريد. لا نعرف حقًا ما نريده: هناك طريقة واحدة بسيطة للغاية وعقلانية ولا جدال…
PROMA. Firma. Materiały chemiczne. Materiały własnej produkcji.
„Zakład Produkcyjno-Budowlany, Jerzy Maciejewski”, obecnie producent chemii budowlanej pod marką „Proma®”, powstał w roku 1990. Początkowo firma była dużym wykonawcą ociepleń. Wykonała ponad 500 tys. m2 elewacji w Warszawie, Toruniu i na terenie…
KAMOKA. Firma. Hamulce, napędy, filtry. Części mechaniczne.
Dynamiczna marka KAMOKA to europejska marka części samochodowych pochodzących z fabryk dostarczających swe wyroby na pierwsze wyposażenie do producentów samochodów. Części samochodowe KAMOKA są wykonane według wysokich standardów i europejskich norm, co…
TWM. Company. Aero plane. Accessories for airplane. Aircraft parts.
All Prototypes have undergone series of flight tests in our private air field before production of models. RADAR Co., Ltd. The World Models Mfg. Co., Ltd. Radar Company Limited was established in 1957. Our main stream business is to distribute world…
Bluza męska szara
: : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : Opis. : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : DETALE HANDLOWE: : Kraj: ( Polska ) : Zasięg…
Ilu z nas na co dzień używa wody do mycia, picia, kąpieli…
Ilu z nas na co dzień używa wody do mycia, picia, kąpieli… a tak naprawdę zapomina o połączeniu się z tym elementem Natury? Czy zdajesz sobie sprawę, ile razy po kąpieli w morzu czujesz się lepiej? Albo ile razy po wzięciu prysznica czujesz się odświeżony…
Kwas hialuronowy czy kolagen? Na jaką procedurę się zdecydować:
Kwas hialuronowy czy kolagen? Na jaką procedurę się zdecydować: Kwas hialuronowy i kolagen to substancje naturalnie wytwarzane przez organizm. Należy podkreślić, że po 25 roku życia ich produkcja zmniejsza się, przez co postępują procesy starzenia się i…
SCRIBA. Producent. Kalendarze.
Wydawnictwo Scriba s.c. swoją działalność rozpoczęło ponad 20 lat temu. W początkowych latach główna aktywność Wydawnictwa skupiała się na polskim rynku wydawniczym. W swej historii nasza firma może poszczycić się ponad 200. wydanymi tytułami. Do…
10 tekenen dat je uitgaat met een emotioneel niet-beschikbare man:
10 tekenen dat je uitgaat met een emotioneel niet-beschikbare man: Wij zijn allemaal op zoek naar iemand die onvoorwaardelijk en voor altijd van ons houdt, niet? Hoewel het vooruitzicht om verliefd te zijn en bemind te worden, ervoor kan zorgen dat je…
ಈಜುಡುಗೆ ಎಲ್ಲಿ ಖರೀದಿಸಬೇಕು ಮತ್ತು ಅದರ ಗಾತ್ರವನ್ನು ಹೇಗೆ ಹೊಂದಿಸುವುದು?66
ಈಜುಡುಗೆ ಎಲ್ಲಿ ಖರೀದಿಸಬೇಕು ಮತ್ತು ಅದರ ಗಾತ್ರವನ್ನು ಹೇಗೆ ಹೊಂದಿಸುವುದು? ಸರಿಯಾದ ಉಡುಪನ್ನು ಆರಿಸುವಾಗ, ನೀವು ಅದರ ಕಟ್ ಮತ್ತು ನೋಟಕ್ಕೆ ಮಾತ್ರವಲ್ಲ, ಎಲ್ಲಕ್ಕಿಂತ ಹೆಚ್ಚಾಗಿ ಅದರ ಗಾತ್ರಕ್ಕೂ ಗಮನ ಕೊಡಬೇಕು. ನಮ್ಮ ಆಕೃತಿಯ ಗಾತ್ರಕ್ಕೆ ಸರಿಯಾಗಿ ಹೊಂದಿಸದಿದ್ದರೆ ಅತ್ಯಂತ ಸೊಗಸುಗಾರ ಈಜುಡುಗೆ ಕೂಡ…
Oregano greckie - bardziej intensywne od zwykłego!
Oregano greckie - bardziej intensywne od zwykłego! Oregano greckie charakteryzuje się ostrym, bardziej intensywnym smakiem niż oregano pospolite. Ma drobniejsze liście. Jest to roślina wieloletnia. Przeznaczenie: Jako przyprawa do pizzy, zapiekanek,…
Soritr'aretin'ny coronavirus araka ny voalazan'ny olona sitrana:
Soritr'aretin'ny coronavirus araka ny voalazan'ny olona sitrana: 20200320AD Ilay coronavirus dia nahay nanapaka an'izao tontolo izao. Ny olona tsy maty tamin'ny otrikaretina coronavirus dia nitantara ny soritr'aretina izay nahafahan'izy ireo nanao ny…
Panel podłogowy: astoria
: Nazwa: Panel podłogowy: : Model nr.: : Typ: Deska dwuwarstwowa : Czas dostawy: 96 h : Pakowanie: pakiet do 30 kg lub paleta do 200 kg : Waga: : Materiał: Drewno : Pochodzenie: Polska . Europa : Dostępność: detalicznie. natomiast hurt tylko po umówieniu…
공공-민간 파트너십, BioNTech, moderna, curevac, covid-19, 코로나 바이러스, 백신 :
공공-민간 파트너십, BioNTech, moderna, curevac, covid-19, 코로나 바이러스, 백신 : 20200320AD BTM Innovations, Apeiron, SRI International, Iktos, 항 바이러스 약물, AdaptVac, ExpreS2ion Biotechnologies, pfizer, janssen, sanofi, 유럽위원회 (European Commission)는 3 월 16 일 코로나 바이러스 백신에…
Psy bojowe Asyrii to lawina psów w zbroi i kolczugach, która przetoczyła się przez wroga przed oddziałami Asyryjczyków, siejąc panikę.
Psy bojowe Asyrii to lawina psów w zbroi i kolczugach, która przetoczyła się przez wroga przed oddziałami Asyryjczyków, siejąc panikę i przerażenie na wrogu. W Asyrii istniał specjalny oddział wojska – kynologiczny. Wyszkolili specjalistów spośród…
METATRON:
METATRON: „Jeśli wszyscy na świecie zaczną skupiać się na swoim wewnętrznym pięknie, uzyskując do niego dostęp, emanując je i rozpoznając je w innych, sposób, w jaki wszyscy postrzegamy świat, zostanie zmieniony, nawet wewnętrzne plany. Sposób, w jaki…
மன ஆரோக்கியம்: மனச்சோர்வு, பதட்டம், இருமுனை கோளாறு, பிந்தைய மனஉளைச்சல் சீர்கேடு, தற்கொலை போக்குகள், பயங்கள்:6:
மன ஆரோக்கியம்: மனச்சோர்வு, பதட்டம், இருமுனை கோளாறு, பிந்தைய மனஉளைச்சல் சீர்கேடு, தற்கொலை போக்குகள், பயங்கள்: வயது, இனம், பாலினம், வருமானம், மதம் அல்லது இனம் ஆகியவற்றைப் பொருட்படுத்தாமல் அனைவரும் மனநோயால் பாதிக்கப்படுகின்றனர். அதனால்தான் உங்கள் மன…